两例新生仔猪流行性腹泻的诊断分析与防控建议
- 点击次数:
- 日期:2012-02-20 19:17
- 编辑:admin
- 来源:广东养猪信息网
- 评论
曲向阳1 ,2 汪鸣1 姚火春1*
(1.南京农业大学动物医学院,南京,210095; 2. 美国礼来亚洲公司上海代表处,上海,200021;)
中图分类号:S858.28 文献标识码:B 文章编号:
传染性胃肠炎(Transmissible Gastro-Enteritis,TGE)、猪流行性腹泻(Porcine Epidemic Diarrhea, PED)、轮状病毒感染(Rotavirus Infection)是导致冬春季节新生仔猪病毒性腹泻的三大重要病因。从2010年10月份开始,新生仔猪病毒性腹泻在东南亚多个养猪国家呈现高发病率、高死亡率的流行态势,波及我国南方10余个养猪大省,死亡仔猪超过100万头[1],给我国养猪行业造成了巨大的经济损失。目前对其病因的研究与探索还在持续,尚未达成统一看法,如:“博卡病毒说”,“底色病说”等等。自2011年12月中旬起,仔猪的病毒性腹泻在华东地区多家规模化猪场再次爆发,现将其中两例的诊断与防控建议汇报如下,以期与同行探讨。
1 发病状况
自2011年12月中下旬起,华东地区两家规模化猪场(猪场A与猪场B)先后发生大规模的腹泻。发病急,传播快,7天内各生产阶段的猪均出现腹泻。不同年龄阶段猪只的发病顺序也基本一致,均是育肥猪先出现水样腹泻,而后传染至保育猪,再到妊娠母猪,最后是产房母猪与哺乳仔猪。两猪场均曾使用流行性腹泻-传染性胃肠炎二联灭活疫苗在妊娠后期进行后海穴注射免疫,免疫2次。
2 临床症状
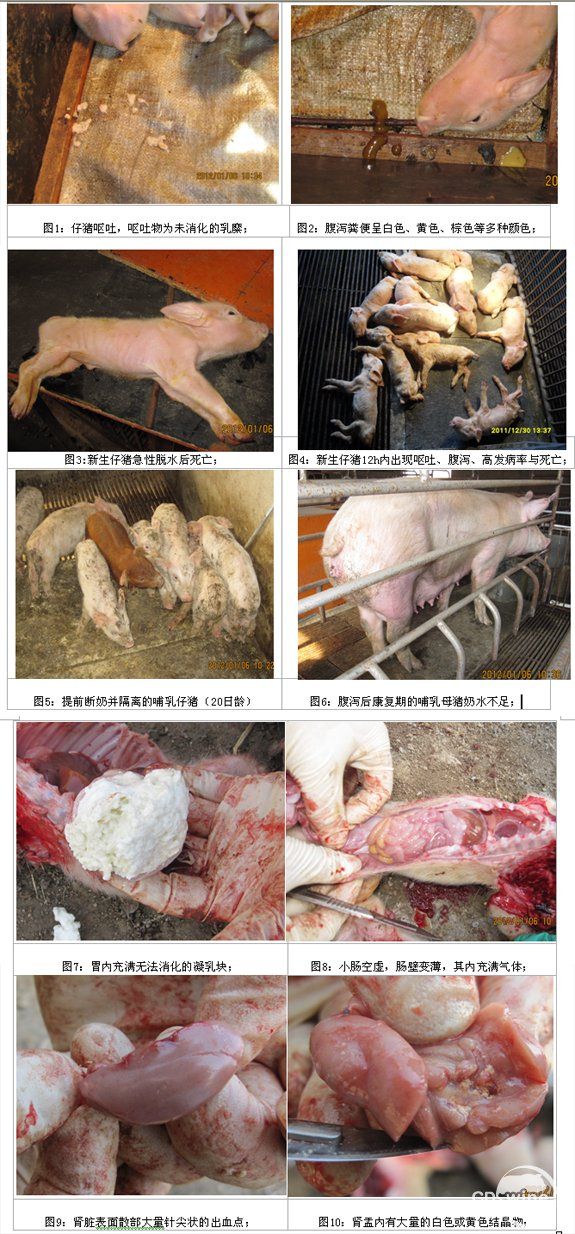
育肥猪、保育猪与母猪呈水样腹泻,粪便呈水泥浆样或黄色。哺乳仔猪通常在出生后12小时内出现呕吐(图1),随后开始腹泻,粪便常呈黄色、棕色、白色等,颜色不一(图2),脱水后畏寒,迅速发生死亡(图3),7日龄内的猪只发病率几乎100%,死亡率高达70~80%(图4)。腹泻的保育猪消瘦,体表常被稀粪污染,扎堆(图5)。哺乳母猪腹泻时或腹泻康复期后,常出现乳房萎缩,奶水不足(图6)。
3 病因诊断
3.1 剖检病变
猪场A与猪场B发病仔猪的共同病变如下:脱水严重,皮肤无弹性(图2)。胃内充满未消化的乳糜(图7)。小肠空虚,肠壁变薄,常充满气体(图8)。肾脏表面散布着大量的针尖状出血点(图9),其它脏器无显著一致性病变。但猪场A多头仔猪的肾盂内有大量的结晶物(图10),可能与在哺乳母猪饲料中添加大量的磺胺类药物有关。
3.2 实验室诊断
3.2.1 病料采集。猪场A:采集以下病料 a.发病仔猪的小肠及其内容物;b:康复10~12天的后备母猪、1胎次母猪及经产母猪的粪便;c:正在发病的20日龄仔猪的粪便;猪场B:采集发病仔猪的小肠及内容物。疫苗样品:某品牌的流行性腹泻与传染性胃肠炎二联活疫苗。
3.2.2 病料预处理。仔猪小肠:剪取2cm肠管,剪碎,用PBS 以1:10的重量体积比进行稀释后匀浆,混合物于4℃ 2000g离心15min,收集上清液,立即提取RNA。粪便样品:用PBS 以1:10的重量体积比进行稀释后,涡旋混匀,该混合物于4℃ 2000g离心15min,收集上清液,立即提取RNA。
3.2.3 RNA提取与反转录:按照Geneaid公司病毒核酸提取试剂盒说明书提取RNA。根据宝生物工程(大连)有限公司RT-PCR试剂盒(TaKaRa Code:DRR036A)说明,采用10μL的反转录反应体系:5×RT Master Mix 2μL、Total RNA 4μL、RNase Free dH2O 4μL,混匀后,于PCR仪上进行反转录:37℃ 15min,85℃ 5 min。
3.2.4 PCR检测:1)PEDV的检测:根据GeneBank收录的PEDV M基因c DNA序列(登陆号JF690778.1),设计合成引物,用于扩增PEDV的M基因片段(317bp)。引物序列如下:M1:5’-CATTCGGTTGTGGCGCAGGAC-3’(M基因297~317);M2:5’-CGCCGTGTTTGGACCGGACATA-3’(M基因592~613)。采用20μL的PCR反应体系,混匀后进行扩增,扩增条件为:95℃预变性5min;95℃变性30s,59℃复性30s,72℃延伸30s,30个循环;72℃终延伸5min。1%琼脂糖凝胶电泳观察结果。
2) TEGV的检测:与PEDV的检测过程类似。所扩增目的片段长度为:792bp。
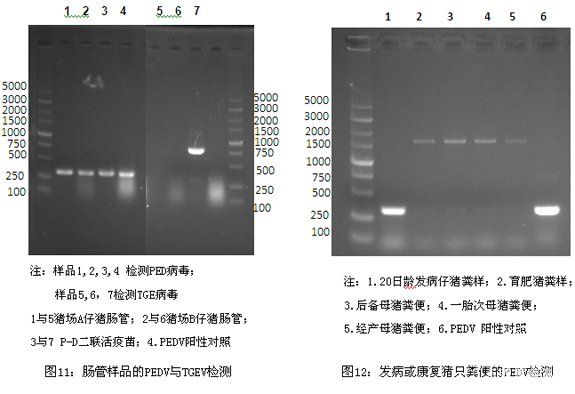
3.2.5 RT-PCR检测结果 从图11可知,猪场A与猪场B腹泻仔猪的肠管样品均是流行性腹泻病毒呈阳性,传染性胃肠炎病毒呈阴性。而P-D二联活疫苗呈传染性胃肠炎与流行性腹泻双阳性。图12可知,腹泻仔猪的粪便样品呈流行性腹泻病毒阳性,而腹泻结束后10~12天的生长育肥猪、后备母猪、一胎母猪及经产母猪的粪便样品均呈流行性腹泻病毒阴性。说明处于康复期(腹泻结束后10左右)的猪只不再通过消化道途径向环境中排毒。
根据临床症状、剖检病变及实验室检测可判断:这两例哺乳仔猪腹泻均是由流行性腹泻病毒感染所导致。
4 控制措施
目前针对流行性腹泻尚无特异性治疗方法,疫苗紧急免疫效果也不佳,建议多采取支持性治疗。
4.1 哺乳仔猪
a.保温:做好产房,特别是保温箱等局部的保温工作,7日龄内的仔猪,产房局部温度应控制在28℃~32℃之间;
b.补液:利用5%的葡萄糖生理盐水(提前预热至35℃)进行腹腔补液,每次30毫升,每天2~3次;
c.防饥饿:当哺乳母猪奶水较差时,应及时进行交叉寄养或采用米汤水或人工乳进行人工饲喂,防止仔猪饿死;
d.生物安全与清洁卫生:减少人员流动,加强卫生消毒措施,并注意控制产房内的湿度(40%~80%之间)。
4.2 保育仔猪、生长育肥猪
a.适当限饲:在腹泻期间,将发病猪群的饲料添加量降低为正常水平的三分之一,尽量使用湿拌料。
b.加强补液,防止仔猪脱水,添加电解多维,防止酸中毒,适当的添加一些抗生素,如金霉素、阿莫西林等,防止大肠杆菌或沙门氏菌等继发感染。同时,做好保温与卫生消毒工作。
4.3 后备母猪、妊娠母猪及哺乳母猪
a.返饲:利用发病24小时内的哺乳仔猪小肠管及其内容物、粪便等破碎,匀浆后,加上一定剂量抗生素(如青链霉素、庆大霉素、新霉素等)后,分两批次进行返饲,并及时进行返饲效果跟踪判断;(具体方法见下文叙述)。
b.催乳:母猪腹泻后,常出现奶水不足的状况,造成仔猪大量死亡。可通过调整哺乳料的营养水平或添加催乳剂等饲料添加剂来增加母猪奶水。
5 讨论与小结
5.1 猪流行性腹泻
猪流行性腹泻是由冠状病毒(猪流行性腹泻病毒)感染所导致一种以水样腹泻、猪只逐渐消瘦为主要特征的病毒性疾病。可感染各生长阶段的猪只,在欧洲该病对断奶仔猪与生长育肥猪的影响较大,对哺乳仔猪的影响比较温和(即使没有PED母源抗体存在)[2],但在亚洲该病对哺乳仔猪的影响非常大,死亡率可高达80%以上。好发于冬春寒冷季节,但2011年山东以南各省份全年均有急性病例,东北三省的发病率相对较低。主要临床症状为猪只食欲减退、呕吐、腹泻、脱水、甚至死亡。剖检主要病变为肠壁(特别是小肠壁)变薄甚至呈半透明状,胃内常充满未消化的凝乳块[2]。其临床症状、剖检变化与传染性胃肠炎非常相似。与之前的报道所不同的是:在这两个病例中均发现肾脏表面散布着大量的针尖状小出血点。但通过RT-PCR检测确定猪场A与猪场B的仔猪肠管样品中均呈流行性腹泻病毒阳性。此检测结果与Sun RQ等人[1] 在2010~2011年对我国9家规模化猪场病毒性腹泻的检测结果一致[1],导致10日龄内哺乳仔猪的发病率与死亡率高达80%。据国际兽医局(OIE)调查,猪流行性腹泻与猪繁殖与呼吸系统综合征是近年来影响亚太地区养猪工业最重要的两种疾病[3]。
流行性腹泻病毒(PEDV)主要通过粪便进行传播,也可通过患病哺乳母猪的奶水进行传播[1],通过粪-口途径进行感染。经检测,这两个发病猪场的患病仔猪粪便均呈PEDV阳性,但猪场A康复10~12日后妊娠母猪与哺乳母猪粪便样品均呈PEDV阴性,说明康复10日后,猪只不再向外界环境排毒。DaeSub Song等人[4]使用Vero细胞致弱的PEDV通过口服方式人工感染2周龄的哺乳仔猪与妊娠后期母猪,发现仔猪通过粪便最长病毒排毒时间为感染后的第9天,而母猪最长的向外排毒时间为感染后的第3天。两者的结论一致,但野毒对外排毒的持续期可能比致弱毒株要长些[5]。在本案例中,这些康复母猪所分娩的新生仔猪依旧发病了,可能原因如下:第一,因栋舍设计限制,本猪场在发病期间也无法做到全进全出,加之消毒措施不彻底,环境中存在的PED病毒会感染新生仔猪;第二,虽然康复母猪或经过返饲(猪场A)的母猪已产生了母源抗体,但哺乳母猪的奶水普遍不佳(图6),无法通过奶水中的母源抗体来保护新生仔猪。
5.2 猪流行性腹泻疫苗与免疫失败原因分析
开发高效的猪流行性腹泻疫苗是当前科学界面临的一个巨大挑战。在本次疫情中,虽然两猪场在妊娠母猪分娩前利用流行性腹泻-传染性胃肠炎二联灭活疫苗(疫苗毒株:CV777)进行跟胎免疫,但猪群发病快,仔猪死亡率高,说明当前所用疫苗的保护率不佳。主要的原因可能如下:1)疫苗毒株:流行性腹泻病毒变异较快,各国的疫苗毒株也有所不同,如日本:P-5V,韩国:KPEDV-9[6]。冠状病毒的纤突蛋白(S)基因变异性高且能够诱导产生中和抗体[ 7]。据Sun RQ等人[1]报道,2010~2011年所检测的仔猪流行性腹泻病毒S基因部分片段与疫苗株CV777之间的同源性为93.3%~94.7%,基因系统进化分析表明:新病毒株与以往的毒株及疫苗株均有所不同。2)疫苗类型:目前已商品化的疫苗包括灭活疫苗与活疫苗两类,我国以灭活疫苗为主,而韩国与日本以商品化的流行性腹泻活疫苗为主[8]。3)免疫途径:目前我国所使用的灭活疫苗采用后海穴注射免疫。但实验证明:利用Vero细胞致弱的流行性腹泻活疫苗通过不同免疫途径对怀孕后期母猪进行免疫,口服免疫组的死亡率(13%)明显低于肌肉注射组(60%),口服免疫组仔猪体内的IgA抗体的浓度更高[9]。4)抗原含量:流行性腹泻病毒对培养条件要求苛刻,要达到有效的抗原滴度也存在一定的挑战。
5.3 流行性腹泻的复发与返饲技术应用
在本次疫病流行过程中,多家规模化猪场报告其猪场在一个月时间内连续两次爆发流行性腹泻。这可能因为在首次感染时,母猪群未被全部感染,存在一定比例的易感(空白)猪只,使得流行性腹泻病毒得以再次感染易感猪群。美国、加拿大等国家在蓝耳病爆发时,很多猪场管理人员为了缩短蓝耳病对猪群的感染期会使用已发病猪只的血清对全群猪进行同期感染。而在流行性腹泻与传染性胃肠炎的控制上,因商品化疫苗效果欠佳,返饲技术被广泛使用且取得了较好的效果,两者的免疫机理基本类似。所谓的返饲技术就是采用新发病哺乳仔猪的肠管、粪便等(发病24小时内采集病料最佳)病毒携带物通过口服方式感染母猪群,使其通过自然感染的途径产生免疫,新生仔猪通过母乳获得特异性母源抗体而获得保护。
为降低返饲过程中病毒扩散风险,确保返饲措施的效果,应注意以下几点:1) 返饲病料选择:主要为新发腹泻的哺乳仔猪的肠管、内容物及稀便,发病24小时内采集病料为佳;2)生物安全控制:返饲期间的猪只应由专人管理,降低操作人员的走动及与其它工作人员的接触。3)返饲的批次与范围:主要针对妊娠母猪、哺乳母猪及后备母猪群,应分两批次进行。第一批主要针对怀孕100天以内的妊娠母猪及后备母猪,使其在分娩前产生免疫力;第二批主要针对怀孕100天以后的妊娠母猪及哺乳母猪,需等到其断奶后再进行统一返饲。4)返饲效果的判定:5)返饲猪只护理:为防止酸中毒与细菌性继发感染,在返饲期间应在饮水或饲料中添加电解多维与抗生素。
5.4 展望
虽然目前已通过基因序列分析发现导致2010~2012年的流行性腹泻疫情的毒株与以往毒株有所不同,但因分离培养技术与条件的限制,目前仅有少数的实验室能够分离培养该毒株。新毒株的成功分离培养与人工致弱将大力推动我国流行性腹泻活疫苗的研发进程。其次,可进一步研究新毒株基因变异状况,以确定基因变异对病毒毒力、免疫原性及交叉保护性的影响。此外,虽然在2011年,该病波及我国的各养猪大省,但南方的发病率与仔猪死亡率明显高于东北三省。科学有效的流行病学调查,有利于揭示该病流行的流行特点与致病条件。
参考文献
[1] Sun RQ, Cai RJ, Chen YQ, et al. Outbreak of Porcine Epidemic Diarrhea in Suckling Piglets, China[J]. Emerging Infectious Diseases. 2012,18(1):161-162.
[2] Barbara E Straw, Jeffery J Zimmerman, David J Taylor. 猪病学[M].赵德明,张仲秋,沈建忠译.第九版.北京:中国农业出版社,2008:827-840.
[3] R.G. Morales, A.C. Umandal, C.A. Lantican. Emerging and re-emerging diseases in Asia and the Pacific with special emphasis on porcine epidemic diarrhea[M]. Conference OIE. 2007: 185-189.
[4]DaeSub Song, JinSik Oh, BoKyu Kang,et al. Fecal shedding of a highly cell-culture-adapted porcine epidemic diarrhea virus after oral inoculation in pigs[J] Journal of Swine Health and Production. 2005,13(5): 269–272.
[5]Song DS, Yang JS, Oh JS, et al.Differentiation of a Vero cell adapted porcine epidemic diarrhea virus from Korean field strains by restriction fragment length polymorphism analysis of ORF3[J]. Vaccine. 2003,21:1833–1842.
[6]Jiménez G, Correa I, Melgosa MP,et al. Critical epitopes in transmissible gastroenteritis virus neutralization[J]. Journal of Virology. 1986,60:131–139.
[7]D.S. Song, J.S. Oh, B.K. Kang, et al. Oral efficacy of Vero cell attenuated porcine epidemic diarrhea virus DR13 strain[J]. Research in Veterinary Science. 2007,82:134-140.
[8] Kadoi, K., Sugioka, H., Satoh, T.,et al. The propagation of a porcine epidemic diarrhea virus in swine cell lines[J]. Microbiology.2002, 25: 285–290.
[9] Olanratmanee, Annop Kunavongkrit, Padet Tummaruk. Impact of porcine epidemic diarrhea virus infection at different periods of pregnancy on subsequent reproductive performance in gilts and sows[J]. Animal Reproduction Science. 2010,122 (1-2): 42-51.
- 2012-09-19秋冬季节仔猪养殖过程受凉易得病
- 2012-09-10仔猪阶段常发疾病及发生时间
- 2012-08-09仔猪病毒性胃炎中兽医疗法
- 2012-07-24仔猪低血糖症的诊断与治疗
- 2012-07-24仔猪去势小心链球菌感染疾病
- 2012-07-23仔猪养殖过程饲料营养需求分析
- 2012-06-11夏季外购仔猪需要注意八点
- 2012-06-04仔猪断奶的适时日龄应该怎样掌握?
- 2012-05-30如何提高夏季仔猪上市正品率
- 2012-05-25提高仔猪成活率要做实护理措施
| 查看所有评论 最新评论 | |
|
|
|
| 发表评论 | ||||
|
- 母猪配种几个技术要点 1603
- 自繁自养要技术 短期育肥看行情 693
- 猪精液的保存 623
- 怎样防止公猪自淫 595
- 猪场经济效益的无形杀手――猪增生性肠 539
- 防治高致病性猪蓝耳病 455
- 猪场人力资源管理的现状 441
- 春季猪群严重腹泻防治 358
- 最新人工授精技巧标准之采精注意事项 346
- 怎样掌握怀孕母猪的喂料量 345















